La verdad de los cromosomas en el bebé
“En algunos de los recién nacidos estas anomalías se expresan a nivel fenotípico con trastornos en el neurodesarrollo, en la diferenciación sexual o malformaciones; pero en otros muchos casos las anomalías cromosómicas pasarán desapercibidas”, aclara el también presidente de la Sociedad Española de Neonatología (seNeo).
Se estima que entre un 2-3 % de los bebés llegan al mundo con una anomalía congénita y, de ellas, se reconoce un origen genético en el 50 % de los casos. Las enfermedades genéticas suponen un 20-30 % de los ingresos hospitalarios en los países económicamente desarrollados.
Además, para calibrar la cuestión en su justa medida hay que tener en cuenta que estas alteraciones en los cromosomas son tan graves que muchos embarazos no llegan a término: el embrión o el feto fallecen en la matriz, dando lugar a abortos, que en ocasiones llegan a ser fracasos de repetición.
El cribado genómico neonatal mediante pruebas como el Array-GCH , QF-PCR , Cariotipo tradicional y FISH conforman el conjunto de herramientas que a día de hoy diagnostican de forma precoz hasta 40 enfermedades congénitas que se esconden en las células humanas del recién nacido.
“Por tanto, es prioritario desvelar sus secretos antes de que salgan a la luz los síntomas devastadores que se ocultan tras las anomalías cromosómicas. Debemos afrontar las distintas enfermedades con los mejores tratamientos disponibles, precisos y personalizados”, destaca el Dr. Sánchez Luna.
En este sentido, el proyecto de cribado genómico neonatal CrinGenES espera lograr en apenas dos años identificar más de 300 enfermedades raras de inicio pediátrico con opciones terapéuticas.

Tipos de alteraciones en los cromosomas
Cada célula humana normal debe contener 46 cromosomas, 23 pares (50 % maternos y 50 % paternos) formados por ADN y proteínas; y cada cromosoma se compondrá de unos 20.000/25.000 genes.
Los genes atesoran información genética que se transmite de los progenitores a sus descendientes. Estos genes no sólo condicionan el desarrollo y funcionamiento del cuerpo humano, sino que pueden dar lugar a enfermedades de base genética.
Las anomalías cromosómicas se clasifican en dos grupos: numéricas o anomalías citogenéticas, donde se engloban las aneuploidías, deleciones, duplicaciones y traslocaciones o disomías uniparentales; y estructurales, alteraciones moleculares en la secuencia o expresión de un gen.
“En ambas situaciones -señala el Dr. Sánchez Luna– lo que importa es recordar que los genes son los que expresan la información para la síntesis de los metabolitos y las proteínas“.
Las aneuploidías, que pueden ser monosomías o trisomías debidas a un número anormal de cromosomas, se originan por un fallo en la disyunción meiótica (separación de los cromosomas durante la división celular para formar nuevos gametos -óvulos y espermatozoides-).
Son muy frecuentes la trisomía 21 (síndrome de Down, 1/700-800 recién nacidos vivos), la trisomía 13 (enfermedad cardíaca congénita, 1/5.000), o la trisomía 18 (síndrome de Edwards, 1/3.500-5.000), y las que implican a los cromosomas sexuales, como la monosomía X (síndrome de Turner, 1/2.000-2.500).
Los bebés afectados por las alteraciones en los cromosomas que se producen durante disyunción de la mitosis (célula que se divide para formar otras dos idénticas, con el mismo cromosoma que la célula madre) acarrean el fenotipo mosaico (1-2 % de casos).
Estas personas tendrán células con diferente composición genética: células con un material genético normal y células con un material genético anormal. Hablaremos entonces de bebés con un síndrome de Down, Klinefelter o Turner y neurofibromatosis.
Las trisomías por translocación suponen un porcentaje menor (3-5 % en trisomías 21 y 18; y 20 % en trisomía 13).
Se originan por un cambio en la posición de un segmento de un cromosoma a otro, habitualmente del 21, 18 ó 13 al 14 ó 22. Estos casos no se ven influidos por la edad materna.
En la mayoría ocurren de novo, con un riesgo de recurrencia estimado en un 1 % (posibilidad de mosaicismo germinal). Si la madre o el padre portaran la traslocación el riesgo de tener descendencia con desequilibrios cromosómicos alcanzaría el 10-15 % de casos.
La disomía uniparental (DUP) se produce cuando el bebé recibe dos copias de un cromosoma o parte de este sólo desde uno de los progenitores, y nada del otro. Nos enfrentaremos a los síndromes de Prader-Willi, Beckwith-Widemann, Silver-Russell y S.Temple, por ejemplo.
En las alteraciones estructurales de los cromosomas se diagnostican pérdidas, aumento o duplicidad parcial de material genético. También, modificaciones en la ubicación de los segmentos cromosómicos.
Se producen anomalías equilibradas (reordenamiento del material genético, un gen tiene el par de otro, y al revés, sin pérdida ni ganancia) y desequilibradas.
La expresión clínica de las anomalías equilibradas no suele ser tan grave, sobre todo en la etapa neonatal. Los problemas irán apareciendo en algunos bebés según su crecimiento. De hecho, la expresión clínica de la enfermedad se diagnosticará en la edad reproductiva.
Las formas desequilibradas generalmente sí tienen una mayor expresión clínica.
Un ejemplo sería el síndrome de DiGeorge, por deleción o pérdida de segmento de una pequeña parte del cromosoma 22: se arrastra un fragmento añadido en uno de los cromosomas, clásicamente la alteración del grupo 22q11.
Esta alteración en los cromosomas causa problemas en el desarrollo cardíaco y trastornos en las glándulas que mantienen el control del calcio.
Otros ejemplos serían la microduplicación 16p11, isocromosomas, cromosomas en anillo y cromosomas marcador.
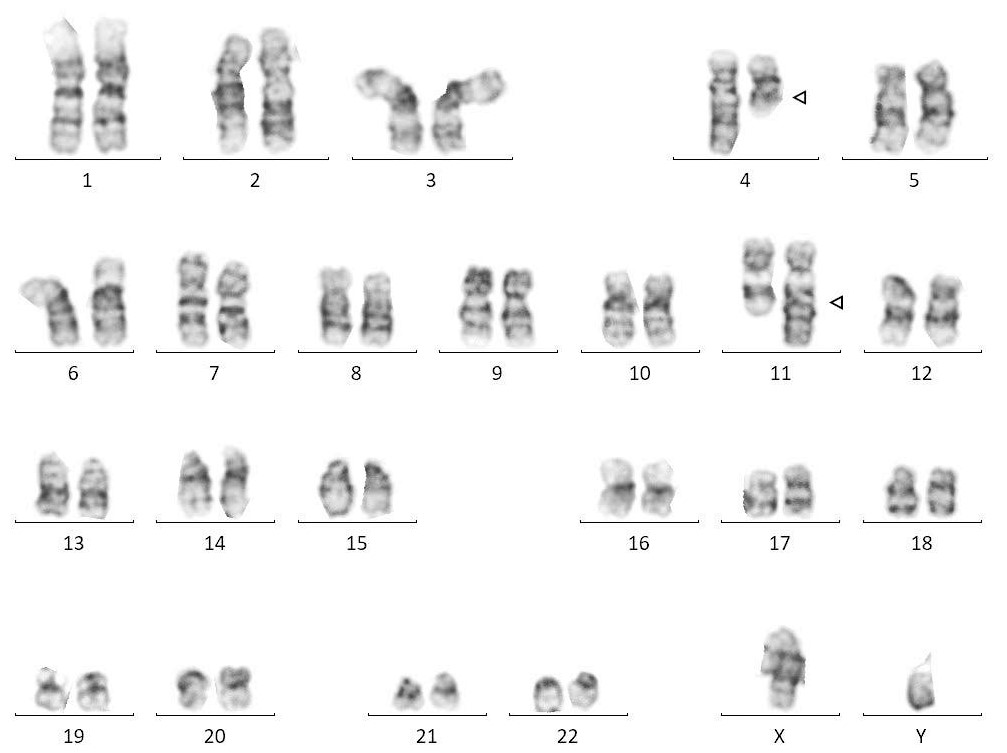

Las pruebas diagnósticas para identificar alteraciones en los cromosomas
“La medicina ha evolucionado muchísimo en el conocimiento de las enfermedades de origen genético o genómico. Hoy sabemos que hasta un 50 % de las más de 7.000 enfermedades raras existentes están mediadas por una alteración genética”, destaca el Dr. Sánchez Luna.
“Cuando somos capaces de identificar estos cambios, podemos dar un nombre a la patología y, muchas veces, establecer un tratamiento precoz para evitar que dichas enfermedades se expresen de forma a veces devastadora en el desarrollo de est@s niñ@s”, subraya.
La investigación, al utilizar diferentes métodos para analizar e identificar los genes, podrá dar lugar a variaciones en los resultados de las estimaciones.
Con la prueba Array-GCH (hibridación genómica comparada) se accede a la detección de delecciones y duplicaciones cromosómicas. Se compara el ADN del paciente con un ADN normal para descubrir pérdidas o ganancias de material genético.
Esta técnica, que aporta una resolución cien veces mayor que el cariotipo clásico, es ideal para analizar anomalías congénitas, rasgos dismórficos, problemas en el neurodesarrollo no filiado y sospechas de síndromes de genes continuos por microdelección o microduplicación.
El Cariotipo (prueba citogenética clásica) nos muestra la imagen típica de los 46 cromosomas ordenados por parejas y características (X e Y).
Es ideal para buscar anomalías en el número o la estructura de los cromosomas: aneuploidías, inversiones, traslocaciones, delecciones y duplicaciones de mayor tamaño que la prueba Array (5-10 Mb).
Permite detectar neonatos con trastornos en la diferenciación sexual, fenotipos claros de trisomías (21, 13 y 18) y, además, sirve para analizar a progenitores que hayan sufrido abortos de repetición e hijos con desequilibrios cromosómicos.
La prueba QF-PCR o reacción de cadena de polimerasa cuantitativa fluorescente detecta rápidamente aneuploidías 21, 13, 18, X e Y en 24-48 horas.
Es en el estudio prenatal invasivo realizado por cribado en el primer trimestre de gestación de alto riesgo por cromosomopatías. También, en neonatos con fenotipo compatible con trisomías y monosomías.
El FISH, o hibridación fluorescente in situ, identifica reordenaciones complejas y crípticas que no se detectan con el cariotipo. Por ejemplo, padres de hijos con delección o duplicación.
Los estudios moleculares dirigidos son pruebas para estudiar alteraciones en un gen o en una región concreta del ADN: secuenciación Sanger, MLPA, mutaciones dinámicas, metilación, NGS, paneles personalizados, exoma (clínico y completo) y estudios de genoma completo (WGS por sus siglas en inglés).


¿Qué es el asesoramiento genético?
Hablamos de un acto clínico-médico que tienen como objetivo ayudar a las personas a entender y adaptarse a las consecuencias médicas, psicológicas y familiares de una enfermedad de origen genético.
Este proceso de comunicación no directiva incluirá la documentación médica de los antecedentes familiares (árbol genealógico de hasta tres generaciones) con el fin de identificar el patrón de la herencia genética y su perfil de riesgo.
Además, es fundamental explicar de forma exhaustiva antes, durante y después en qué consisten las pruebas genéticas aplicables, e informar sobre la prevención, los recursos y tratamientos disponibles, así como contextualizar las investigaciones clínicas en marcha.
El asesoramiento genético debe basarse en el respeto al principio de autonomía del paciente, incluido su derecho a ‘no saber’.
“Además, l@s especialistas determinaremos si estos problemas detectados en los cromosomas pueden tener una carga hereditaria, asunto distinto a tener una carga genética o cromosómica”, apunta el galeno madrileño.
“Debemos identificar perfectísimamente si la alteración cromosómica resultante del estudio puede o no seguir apareciendo en los futuros descendientes de la madre y el padre, como sucede ahora en el bebé analizado”, remarca.
“Por ejemplo, si en este cribado se diagnosticara una trisomía por traslocación podría recomendarse una técnica de reproducción asistida con diagnóstico preimplantacional para el siguiente embarazo”, indica.
Cabe recordar que las trisomías libres, clásicas, que se relacionan muchas veces con el envejecimiento maternal, especialmente, es infrecuente que se repitan. Aún así, siempre se aconseja que se realice un estudio genético a ambos progenitores.
“Las técnicas de diagnóstico genético ayudan a tomar decisiones para que las familias no sólo comprendan qué tipo de enfermedad padece su bebé recién nacido, sino que entiendan los riesgos hereditarios de todo tipo que puedan afectar a sus futuros hijos e hijas”, argumenta el Dr. Sánchez Luna.
El asesoramiento de l@s genetistas, de l@s clínicos, a veces de los equipos de psicólog@s, permitirá a las familias comprender la entidad real de lo que está afectando a su bebé. Entre tod@s debemos evitar que estas enfermedades ocultas en los cromosomas aparezcan de nuevo.
El jueves 8 de mayo de 2025 ampliaremos el contenido de la semana cromosómica y genómica del videoblog de Neonatología con el proyecto CRINGENES, cuya investigadora principal es la Dra. María Luz Couce Pico, jefa del Servicio de Neonatología del Hospital Clínico Universitario de Santiago de Compostela (España).


